I类医疗器械的CE认证怎么做?
2022年03月10日
Shanghai CV
2440
 I 类医疗器械的CE认证途径
I 类医疗器械的CE认证途径
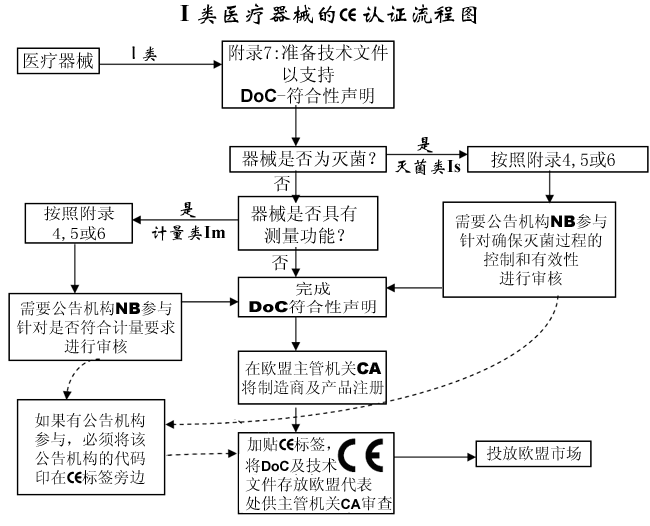
I 类医疗器械的CE认证步骤:
1.分类:确认产品属于I类医疗器械
2.选择符合性评估途径:请参考下面的流程图
3.编制技术文件
4.CE符合性声明
5.委任欧盟授权代表
6.由欧盟授权代表将制造商及产品在欧盟主管机关注册
7.建立售后警戒系统/加贴CE标签并将产品投放市场
I 类医疗器械: CE 符合性评估途径:
1.制造商有责任确保其产品符合MDR指令的所有相关的基本要求,必须制定一份书面(自我)声明来保证。
2.不具备测量功能或非灭菌的I类医疗器械(的CE认证过程中)不需要第三方公告机构(NB)参与。是否符合ISO13485:2016标准,由制造商自愿选择,并非强制性。
3.具有测量功能或灭菌类的I类医疗器械(的CE认证过程中)必须要有第三方公告机构(NB)参与。
4.一旦制造商认为其产品符合MDR指令的所有相关的基本要求,(欧盟境内的)制造商,或者(欧盟境外制造商的)欧盟授权代表必须先在欧盟主管机关注册,然后才可加贴CE标签并将产品投放EEA市场。
- 上一篇:眼镜CE认证
- 下一篇:额温枪CE认证,红外体温计CE认证
上海泽威 (Shanghai CV)
地址:上海市松江区东宝路19号602室
电话:86-21-31261348 / 57712250
电邮:cvtest@126.com
QQ:87033-5905 / 57802-0381
微信:wx578020381 / CVMARK2012

 关注我们
关注我们
 微信公众号
微信公众号
