欧盟Basic UDI-DI
根据欧盟MDR 2017/745法规要求,生产商应当在欧洲医疗器械数据库(EUDAMED)中对其医疗器械产品进行注册并登记相关的唯一医疗器械标识(UDI)。虽然EUDAMED目前还未开放UDI注册模块,但是从2021年5月26日起,生厂商应对其医疗器械产品分配UDI,包括Basic UDI-DI。
什么是Basic UDI-DI?
Basic UDI-DI是EUDAMED数据库中与设备相关的主要访问密钥,也应在相关文件(如证书、符合性声明、技术文件、安全性和临床性能总结等)中引用,用于连接具有相同预期用途、风险等级和基本设计和制造特征的设备。
它独立于设备的包装/标签,不应出现在任何设备或设备标签上。
任何Basic UDI-DI都应以独特的方式识别Basic UDI-DI覆盖的设备(组)。
欧盟的Basic UDI-DI和UDI-DI有什么区别?
Basic UDI-DI是用来关联某个或某组产品的唯一标识,不会打印在产品/标签上,******长度为25个字符。
UDI-DI由14位数字组成,会打印在产品/标签上。
一张证书/一套技术资料可体现多个Basic UDI-DI。
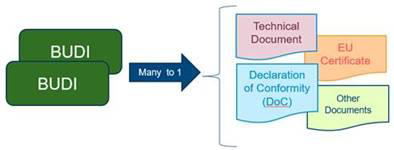
哪些文件需要引用Basic UDI-DI?
a. 技术文件(提供给公告机构的)
b. 符合性声明
c. 产品证书
d. 自由销售证书
e. 安全和临床性能摘要(SSCP)
f. 警戒和上市后监督报告
g. 上市后临床调查表格
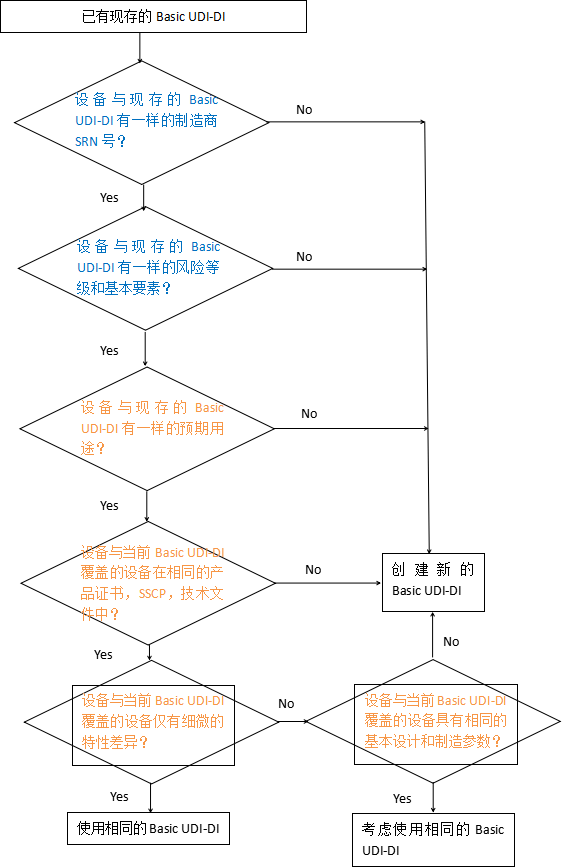
是否需要新的Basic UDI-DI?
①参照以下流程图判断是否需要新的Basic UDI-DI
注:由EUDAMED数据库设计产生的规则用蓝色字体表示,由MDCG Basic UDI-DI指南的考虑用橙色字体表示。
②以下打(*)号的内容如发生变更需要新的Basic UDI-DI
设备(Device)

系统或程序包(System or Procedure Pack)

★ 任何有关注册的问题,敬请咨询上海泽威。
- 上一篇:核酸检测试剂盒CE认证
- 下一篇:CE标志常见问题解答
地址:上海市松江区东宝路19号602室
电话:86-21-31261348 / 57712250
电邮:cvtest@126.com
QQ:87033-5905 / 57802-0381
微信:wx578020381 / CVMARK2012

 关注我们
关注我们
 微信公众号
微信公众号
