FDA注册-药品数量申报流程
FDA规定制造商应为商业分销而制造、制备、繁殖、复合或加工的每种所列药物的数量必须进行年度报告。FDA提供了NextGen网站,药物注册人及其授权代理人应通过登录该网站报告所需数据。 数据由 DUNS、业务运营和 NDC 报告。
申报时间节点:
2020日历年的报告应不迟于2022年2月15日提交,2021日历年的报告应不迟于2022年5月16日提交。后续日历年的报告应在下一个日历年的2月15日之前提交。例如,在2022日历年的上市药物以供商业分销的注册人应在2023年2月15日之前向 FDA 提交报告。
报告内容:
报告应提供由国家药品代码 (NDC) 确定的每种上市药品的数量,该数量由每个注册企业在报告年度内按每个月发布的药品数量发布。再包装商和再贴标签商还应在其报告中包括来源NDC(即,再包装商/再贴标签商收到的用于再包装或再贴标签的药品的完整三段NDC)。
注册人还应报告与当年在注册机构为上市药品开展的整体业务运营最相关的单一业务运营。 第510(j)(3)节报告中提供的业务运营信息可能不同于药品清单中包含的业务运营信息,因为药品清单文件可能包含多个业务运营,而510 (j)(3) 报告应确定单一的业务运营。
成品剂型产品包装类型:
药品数量报告主要有三种情况,分别是单一包装、多级包装和成套产品包装。
如果FDA将产品列为单一包装,则报告的数量应仅对应于与NDC分配给已发布产品的 包装类型的数量、NDC、包装说明和报告数量之间的关系如表1所示:

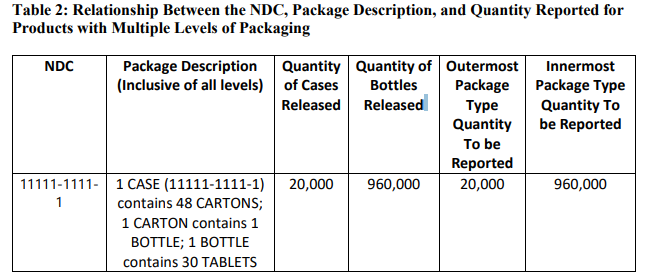
如果产品被FDA列为具有多级包装且产品未列为成套产品,则应使用NDC分配的最外层包装数量和最内层包装报告产品数量。最内层包装即直接包装产品的包装类型。例如,一箱药品(最外层包装)有48个纸箱,每纸箱包含一瓶(最内层包装),一瓶里有30片药片,报告数量应包括NDC分配的箱子瓶子的数量。NDC、包装说明和报告数量之间的关系如表2所示:
如果是成套产品,报告的数量应基于NDC分配给已发布成套产品的最外层包装。
流程:
FDA经授权要求注册人以电子表格形式提交药品数量报告。
一般来说,提交过程包括三个步骤:
验证提交者信息:显示提交者信息。此信息会根据您在注册帐户时提交的信息自动填充。
描述提交:系统将提示您提供有关提交的信息。具体来说,您将被要求确定您在提交中的角色、提交将涵盖哪个日历年以及您将如何完成报告(即通过手动提交或通过从CSV文件上传数据)。
完成报告:系统将提示您通过手动输入或从适当格式的CSV文件上传数据来完成报告。
- 上一篇:医疗器械网络安全管理
- 下一篇:没有了!
地址:上海市松江区东宝路19号602室
电话:86-21-31261348 / 57712250
电邮:cvtest@126.com
QQ:87033-5905 / 57802-0381
微信:wx578020381 / CVMARK2012

 关注我们
关注我们
 微信公众号
微信公众号
