加拿大医疗器械注册—MDL认证篇
2021年05月11日
上海泽威
1026
上期我们介绍了加拿大医疗器械营业许可证MDEL认证,本期我们继续介绍加拿大医疗器械许可证MDL认证。
● 哪些产品需要有MDL认证?
依据加拿大医疗器械法规,II类, III类和IV类的医疗器械都需要申请医疗器械许可证(MDL), I类的医疗器械豁免。
尚不清楚该如何判断产品分类的读者可阅读我们往期文章:加拿大医疗器械注册—分类篇
● 2021年MDL评审费
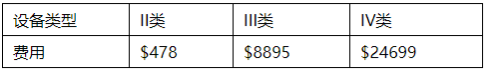
● MDL评审时间
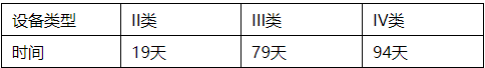
● 文件清单
a. 申请表
b. 设备安全有效的证明材料(如风险分析、有效期验证、包装运输验证、灭菌验证、软件验证、兼容性验证,性能验证等)
c. 标签说明书
● 体系要求
自2019年1月1日起,加拿大强制执行MDSAP,所有II类及以上产品需要提供有效的MDSAP证书。证书有效期3年,每年需进行监督审核,证书到期后需再次认证审核。
想了解MDSAP审核重点的读者可阅读我们往期文章:什么是MDSAP认证?
● MDSAP审核机构
目前拥有MDSAP审核资质的第三方机构一共有16家,大家熟知的BSI,德凯,Intertek,SGS等机构均有资质。
● 有效期
获许可的II,III和IV级医疗设备的制造商需要支付年费(每年11.1日起),以续签许可证。
★有关注册资料编写,测试要求等信息,敬请咨询上海泽威。
- 上一篇:加拿大医疗器械注册—MDEL认证篇
- 下一篇:加拿大医疗器械注册—标签篇1
上海泽威 (Shanghai CV)
地址:上海市松江区东宝路19号602室
电话:86-21-31261348 / 57712250
电邮:cvtest@126.com
QQ:87033-5905 / 57802-0381
微信:wx578020381 / CVMARK2012

 关注我们
关注我们
 微信公众号
微信公众号
